Autores: *Durán Dorantes Mónica Ivette *Esteban Vázquez Brenda Lizbeth *Martínez Palma Laura *Pérez Reséndiz Karla Erika *Pineda Pineda Joyce
jueves, 15 de diciembre de 2011
Teoría cinética
miércoles, 14 de diciembre de 2011
Teoría cinética
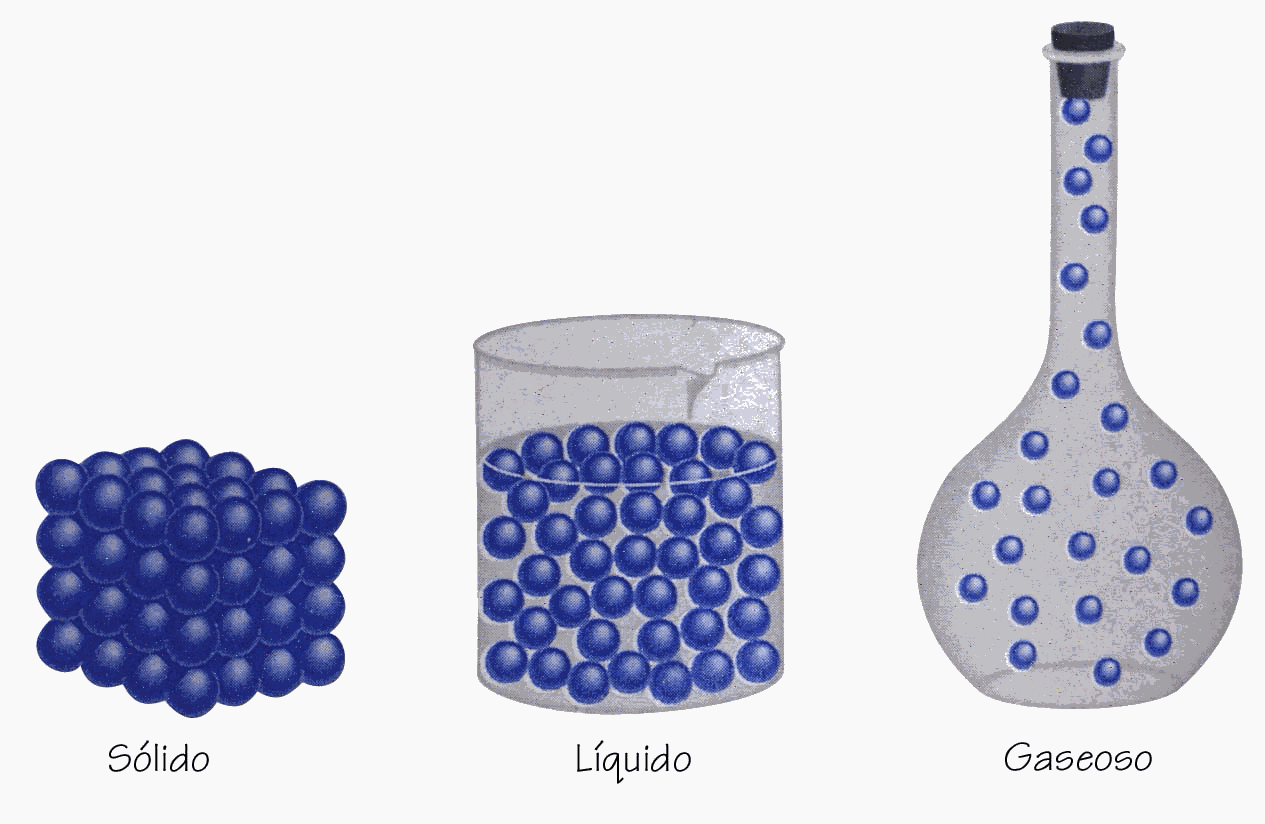
El modelo cinético molecular en sus inicios se desarrollo para los gases, sin embargo se puede aplicar a los tres estados de la materia.
· Estado sólido: las moléculas están muy juntas y se mueven oscilando alrededor de posiciones fijas. En el estado sólido las fuerzas de cohesión son muy grandes.
· Estado líquido: las moléculas están más separadas y se mueven de manera que pueden cambiar sus posiciones, pero las fuerzas de cohesión, aunque son menos intensas que en el estado sólido, impiden que las moléculas puedan independizarse.
· Estado gaseoso: las moléculas están totalmente separadas unas de otras y se mueven libremente; no existen fuerzas de cohesión.
La intervención de la temperatura en la teoría cinética de la materia.
Cuando aumentamos la temperatura de un estado sólido, sus moléculas se moverán más rápidamente y aumentara la distancia entre ellas. Las fuerzas de cohesión disminuyen y llegará un momento en que éstas fuerzas son incapaces de mantener a las moléculas fijas, así las moléculas pueden desplazarse, el estado sólido entonces se va a convertir en un liquido.
Si aumenta la temperatura de un líquido, sus moléculas aumentara su rapidez, la distancia entre ellas irá aumentando y las fuerzas de cohesión van disminuyendo hasta que finalmente las moléculas pueden liberarse unas de otras, y así este conjunto de moléculas se convertirá en estado gaseoso.
Si se disminuye la temperatura de un estado gaseoso, disminuye la rapidez de sus moléculas y así unas a las otras se acercan, esto para que sus fuerzas de cohesión, que siempre aumentan al disminuir la distancia, puedan mantenerlas unidas, así pasará a estado líquido.
Si se disminuye aún más la temperatura, se moverán más lentamente las moléculas, así que la distancia entre ellas seguirá disminuyendo, las fuerzas de cohesión aumentarán más y llegará un momento que son lo suficientemente intensas como para impedir que las moléculas puedan desplazarse, obligándolas a ocupar posiciones fijas, así se ha convierte en estado sólido.
La teoría cinética molecular describe las propiedades y el comportamiento de los gases. Todos los gases están formados por moléculas que se encuentran en movimiento continuo, es rápido, rectilíneo y aleatorio. Las moléculas de los gases están muy separadas entre sí y no ejercen fuerzas sobre otras moléculas. Las hipótesis que fundamentan el comportamiento de este modelo son:
· El gas está formado por un conjunto de N(~1022) moléculas concebidas por pequeñas esferas rígidas de diámetro (aproximadamente 10-8 cm), despreciable comparado con longitudes macroscópicas. Nótese que el volumen ocupado por una molécula es aproximadamente igual a 10-24 cm3. De aquí que ocupado por 1022 moléculas sea apenas de l0-2 cm3: ¡la centésima parte de un cm3! Por tanto, en nuestro recipiente de 1 000 cm3 prácticamente todo el espacio está vacío.
· En ausencia de fuerzas externas y despreciando los efectos del campo gravitacional, las moléculas están distribuidas uniformemente en el recipiente. Esto es, en todo momento número de moléculas por unidad de volumen es constante.
· Las moléculas no ejercen fuerzas entre sí, excepto cuando sufren una colisión con otra molécula o contra las paredes del recipiente. Además, estas colisiones son elásticas.
· Todas las direcciones de las velocidades moleculares son igualmente probables.
· Las magnitudes de las velocidades moleculares cambian constantemente como consecuencia de los choques y, numéricamente, pueden tomar valores entre cero y una velocidad máxima que no puede exceder la velocidad de la luz.

En el siguiente video, se ilustra la composición de un gas y los choques entre sus moléculas.
Postulados de la teoría cinética (Suposiciones).

 3. Se supone que las moléculas obedecen las leyes de la mecánica clásica y se supone que interactúan una con otra sólo cuando chocan. Aunque las moléculas ejercen mutuamente fuerzas atractivas débiles entre colisiones, la energía potencial asociada con esas fuerzas es pequeña en comparación con la energía cinética, y por el momento se le ignora.
3. Se supone que las moléculas obedecen las leyes de la mecánica clásica y se supone que interactúan una con otra sólo cuando chocan. Aunque las moléculas ejercen mutuamente fuerzas atractivas débiles entre colisiones, la energía potencial asociada con esas fuerzas es pequeña en comparación con la energía cinética, y por el momento se le ignora. 
Presión y temperatura
Presión =fuerza/área
La presión que un líquido ejerce depende de la profundidad; sin embargo, también depende de la densidad. Si te sumergieras en un líquido más denso que el agua la presión sería mayor. La presión de un líquido es exactamente igual al producto de la densidad de peso por la profundidad:
Presión del líquido = densidad del peso × profundidad
Densidad de peso=peso/volumen
Se puede expresar este peso de líquido como
Peso = densidad de peso × volumen
Donde el volumen de la columna es tan sólo el área multiplicada por la profundidad. Entonces, se obtiene

= densidad de peso × profundidad
Para la presión total, a esta ecuación se debería sumar la presión debida a la atmósfera sobre la superficie del líquido.
Dicho con sencillez, la presión que ejerce un líquido contra las paredes y el fondo de un recipiente depende de la densidad y la profundidad del líquido. Si no tomamos en cuenta la presión atmosférica, a una profundidad doble, la presión del líquido contra el fondo sube al doble; a tres veces la profundidad, la presión del líquido es el triple, y así sucesivamente.


La cantidad que indica lo caliente o frío que está un objeto con respecto a una norma se llama temperatura. El primer “medidor térmico” para medir la temperatura, el termómetro, fue inventado por Galileo en 1602 (la palabra térmico proviene del término griego para indicar “calor”).
Casi todos los materiales se dilatan, o expanden, cuando se elevan sus temperaturas, y se contraen cuando éstas bajan. Así, la mayoría de los termómetros miden la temperatura debido a la expansión o contracción de un líquido, que suele ser mercurio, o alcohol teñido, en un tubo de vidrio con escala.
Los líquidos y los sólidos también se expanden cuando aumenta su temperatura. A este fenómeno se le llama dilatación. El termómetro funciona porque la sustancia que contiene se expande cuando aumenta su temperatura, y se contrae cuando su temperatura baja.
Recordarás que el modelo cinético de la materia propone que la temperatura de un cuerpo está relacionada con la velocidad promedio a la que se mueven las partículas. Así es; cuando una sustancia se calienta, las partículas que la conforman se mueven más rápido, se alejan cada vez más unas de otras y, en consecuencia, ocupan más espacio. A nivel macroscópico lo que observamos es que el sólido o el fluido se expanden.
En el modelo cinético, la temperatura se define como el promedio de la energía cinética de las partículas que componen el material.
Es sorprendente, podernos dar cuenta que la física está en todas partes, pongamos de ejemplo la "tromboflebitis", comunmente conocida como "várices", que es básicamente la inflamación de una vena, pero... ¿Qué factores influyen?, en el caso de la mujer, es el uso de tacones, ya que con estos se tiene una menor area de apoyo y como consecuencia se ejerce una presión mayor al piso. De tal forma que podemos decir que la fuerza ejercida por la presión en un fluido es la misma en todas direcciones a cualquier profundidad y su magnitud depende de la profundidad.
Para asombro de muc hos, no sólo el uso de tacones es causa de este padecimiento, de igual forma las posibilidades de desarrollarlo aumentan considerablemente al vivir en una zóna cálida , ya que los líquidos tienden a dilatarse al aumentar su temperatura, el volumen de la sangre que contiene la vena, aumenta.
hos, no sólo el uso de tacones es causa de este padecimiento, de igual forma las posibilidades de desarrollarlo aumentan considerablemente al vivir en una zóna cálida , ya que los líquidos tienden a dilatarse al aumentar su temperatura, el volumen de la sangre que contiene la vena, aumenta.
Movimiento Browniano.

martes, 13 de diciembre de 2011
Leyes de los gases y Ley general de los gases
- Ley de Boyle-Mariotte
P=presión
V=volumen
K=constante de proporcionalidad
Esta constante depende de las unidades usadas, la masa del gas y la temperatura.

En la gráfica de P contra V da como resultado la hipérbola característica que corresponde a la ecuación de la ley. Si se repite el experimento a temperaturas diferentes se genera una familia de hipérbolas, y debido a que la temperatura es constante a lo largo de cada línea, éstas curvas se denominan isotermas, como resultado se observa un proceso isotérmico en el que la temperatura permanece constante.
Como la energía interna de un gas sólo es función de la temperatura, en un proceso isotérmico de un gas la variación de la energía interna es cero.

Ley de Charles
En 1787 el francés J. Charles sin proponérselo fue el primero en subir en un globo cuando su ayudante lo soltó por accidente y fue el inventor del globo aerostático de hidrógeno.
Cuando se mantiene constante la presión, el volumen de determinada cantidad de cualquier gas varía en forma directa con la temperatura termodinámica.
V/T=K que es igual a V1T1=V2T2 donde:
V=volumen
T=temperatura absoluta
K=constante de proporcionalidad
Ley de Gay-Lussac
En 1802 Gay-Lussac con sólo encerrar un gas en un matraz y obturando con un líquido el conducto por donde se ejerce la presión atmosférica y posteriormente calentando un poco el conjunto observó el aumento de volumen del gas, afirmando que:
Cuando se mantiene constante el volumen, la presión absoluta de determinada cantidad de cualquier gas varía en relación directa con la temperatura termodinámica.
P/T=K que es igual a P1T1=P2T2 donde:
P=presión
T=temperatura
K=constante de proporcionalidad

Ley general de los gases
Esta ley combina las variables de presión P, volumen V y temperatura T de las leyes de Boyle, Charles y Gay-Lussac para calcular un nuevo volumen cuando cambian tanto la presión como la temperatura y se enuncia así:
Los volúmenes ocupados por una masa gaseosa son directamente proporcionales a las temperaturas absolutas e inversamente proporcionales a las presiones que soportan.
PV/T=P’V’/T’
El diafragma para inhalar, tira hacia abajo, aumenta el volumen torácico y hace disminuir la presión pero ahora la presión en los pulmones es negativa y el aire entra en ellos. Cuando el tórax se comprime y el diafragma se mueve hacia arriba, la presión torácica aumenta, la presión manométrica en los pulmones se torna positiva y el aire es expulsado.
Los gases medicinales como el oxígeno y el nitrógeno requieren ser almacenados en recipientes metálicos a altas presiones sobre todo para su manejo y posterior distribución en recipientes más pequeños para la oxigenoterapia donde el oxígeno líquido medicinal por medio de un adecuado sistema de intercambio de calor, el oxígeno se evapora y llega al paciente en estado gaseoso y a temperatura ambiente, otro ejemplo es la combinación de oxígeno con nitrógeno en el protóxido de nitrógeno principalmente utilizado en la anestesia y analgesia.
Haz click AQUÍ, para observar de manera gráfica los cambios en el volumen del gas cuando aumentas o disminuyes la temperatura o la presión.
Bibliografía
- Cromer, Alan. Física para las ciencias de la vida. Barcelona, Reverté, 2007.
- Hecht, Eugene. Fundamentos de física. México, Thomson, 2004.
- Giancoli, Douglas C. Física con aplicaciones. México, Pearson Educación, 2006.
- Audesirk, Teresa. Biología ciencia y naturaleza. México, Pearson Prentice Hall, 2008.
- W. Sears, Francis et al. Física universitaria volumen 1. México, Pearson, 2004.
- Wilson, Jerry D. Física. México, Pearson Educación, 5a edición, 2003.







